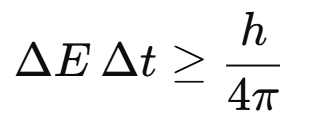6. Ondas de materia de De Broglie y Principio de Incertidumbre de Heisenberg
Las aportaciones de Louis de Broglie y Werner Heisenberg marcaron un cambio decisivo en la física moderna. De Broglie propuso que toda partícula posee una naturaleza ondulatoria, mientras que Heisenberg estableció el principio de incertidumbre, que limita la precisión con que pueden conocerse simultáneamente la posición y el momento de una partícula. Juntas, estas ideas dieron origen a la mecánica cuántica.
Ondas de materia de De Broglie
En 1924, Louis de Broglie propuso una idea revolucionaria:
"Así como la luz (que se creía una onda) también puede comportarse como partícula (fotón), las partículas materiales también deben comportarse como ondas."
Esto dio origen al concepto de dualidad onda-partícula, que afirma que toda partícula con momento lineal tiene una longitud de onda asociada.

La longitud de onda de De Broglie se calcula con la fórmula:
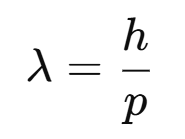
Si consideramos la definición de cantidad de movimiento lineal, la longitud de onda de De Broglie se calcula:
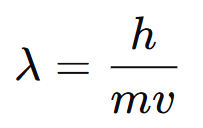
Si la masa mmm es grande (una pelota, una persona, un auto), la longitud de onda es extremadamente pequeña → no se nota el comportamiento ondulatorio.
Si la masa es muy pequeña (como la de un electrón), la longitud de onda es comparable a dimensiones atómicas, y los efectos cuánticos se hacen observables.
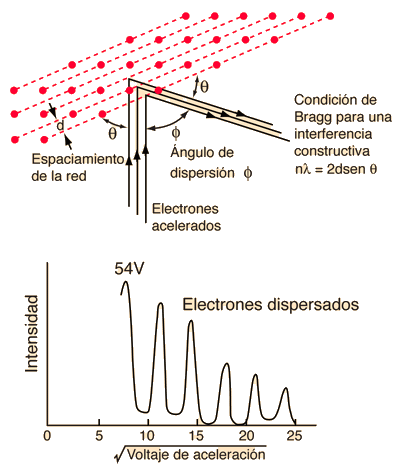
Experimento de Davisson y Germer
En 1927, Davisson y Germer comprobaron experimentalmente las ondas de De Broglie al observar difracción de electrones al chocar contra un cristal de níquel.
El patrón de interferencia era igual al que producen las ondas luminosas, confirmando que los electrones tienen comportamiento ondulatorio.
Interpretación Probabilística
El cuadrado de la función de onda ∣Ψ∣^2 representa la probabilidad de encontrar la partícula en una región del espacio.
De Broglie fue el primero en sugerir que el estado cuántico de un electrón en el átomo se debía a una onda estacionaria que solo puede existir si su longitud de onda encaja exactamente en la órbita:
La interpretación probabilista, también conocida como interpretación de Copenhague, fue desarrollada principalmente por Niels Bohr y Werner Heisenberg en la década de 1920.
Esta visión sostiene que, en el mundo cuántico, no es posible predecir con certeza el comportamiento de una partícula, sino solo la probabilidad de encontrarla en determinado lugar o con cierta energía.
Según esta interpretación, el estado cuántico de una partícula se describe mediante una función de onda Ψ (propuesta por Schrödinger).
El cuadrado de su módulo, ∣Ψ∣^2, indica la probabilidad de presencia del electrón u otra partícula en una región del espacio.
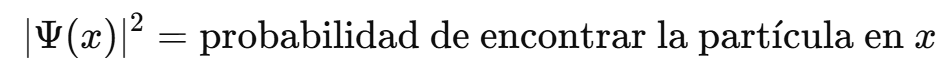
Antes de realizar una medición, la partícula no tiene una posición o velocidad definidas; se encuentra en una superposición de estados posibles.
Al medirla, esa superposición colapsa, y la partícula adopta un valor específico.
Principio de Incertidumbre de Heisenberg

Formulado por Werner Heisenberg en 1927, este principio establece que no es posible conocer simultáneamente y con precisión absoluta la posición y el momento (cantidad de movimiento) de una partícula.
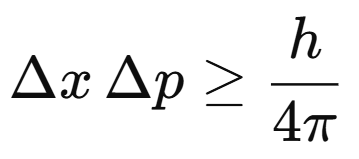
Esto significa que, cuanto más exactamente se mide la posición de una partícula, menos certeza se tiene sobre su velocidad o cantidad de movimiento, y viceversa.
Heisenberg formuló otra expresión del principio que relaciona la incertidumbre en la energía de un sistema (ΔE) con la incertidumbre en el tiempo durante el cual esa energía puede ser medida (Δt):