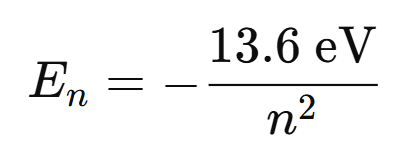5. Modelos atómicos de Rutherford y Bohr
En este apartado abordaremos los modelos atómicos de Rutherford y de Bohr para comprender como el avance de los modelos atómicos contribuyeron a la consolidación de la Física Cuántica.
Modelo atómico de Rutherford (1911)
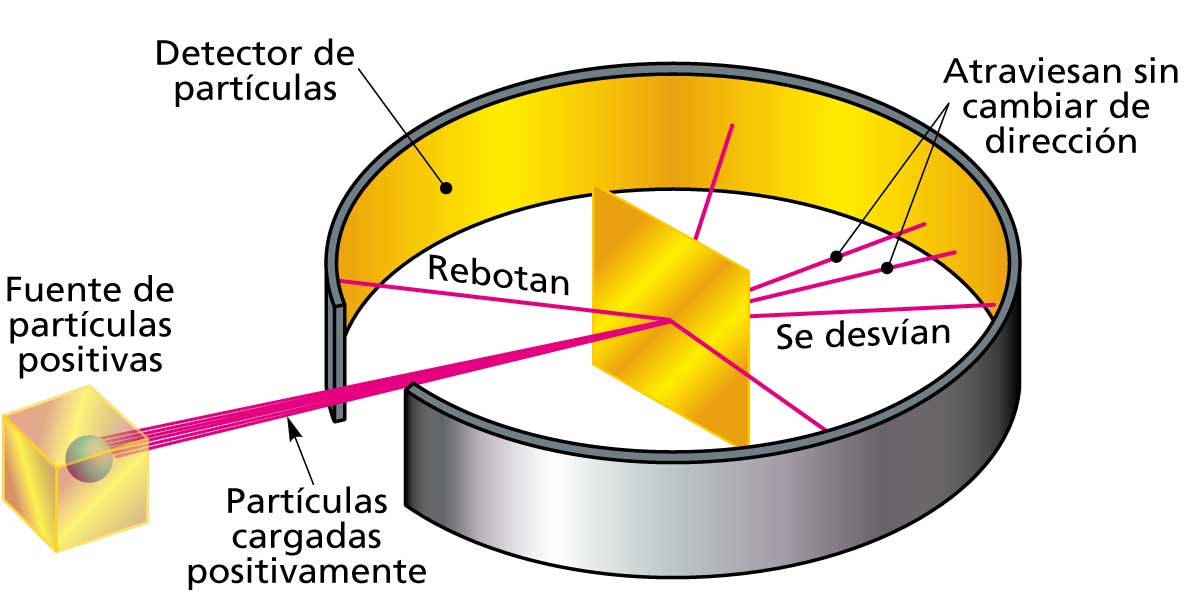
Rutherford y sus colaboradores (Geiger y Marsden) bombardearon una lámina muy delgada de oro con partículas alfa (α).
Esperaban que todas pasaran sin desviarse, según el modelo de Thomson ("pudín de pasas"), pero observaron que algunas se desviaban fuertemente e incluso rebotaban.
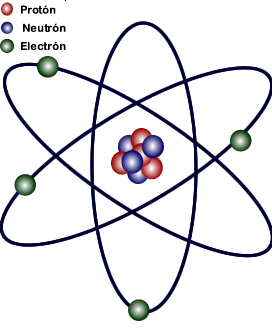
El átomo tiene un núcleo pequeño, denso y con carga positiva, donde se concentra casi toda la masa.
-
Los electrones giran alrededor del núcleo a gran distancia, en una región casi vacía.
-
La mayor parte del volumen del átomo está vacío.
Limitaciones del átomo de Rutherford
-
Según la física clásica, un electrón en movimiento debería emitir radiación y perder energía, cayendo en espiral al núcleo.
-
Por tanto, el modelo no podía explicar la estabilidad del átomo.
-
Tampoco explicaba los espectros de líneas de los elementos.
Modelo atómico de Bohr (1913)
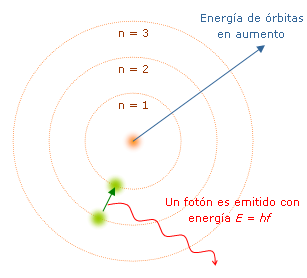
Bohr, basándose en el modelo nuclear de Rutherford y en la teoría cuántica de Planck, propuso un modelo cuántico del átomo de Hidrógeno.
Postulados
-
Los electrones se mueven en órbitas circulares alrededor del núcleo sin emitir energía.
Cada órbita tiene una energía fija o nivel cuántico. -
El momento angular del electrón está cuantizado:
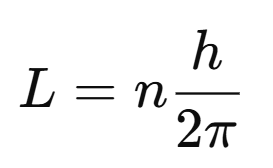
donde n=1,2,3,... (número cuántico principal).
3. Un electrón emite o absorbe un fotón cuando salta entre dos niveles:
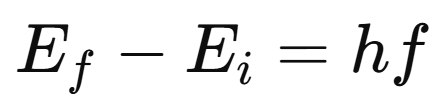
Si Ef<Ei, el átomo emite un fotón.
Si Ef>Ei, el átomo absorbe un fotón.
Radio de la órbita de Bohr
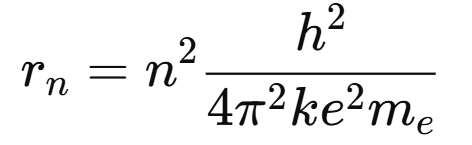
Para el Hidrógeno:
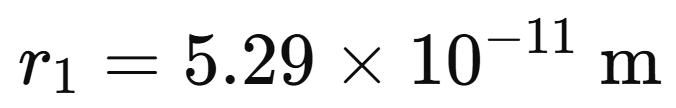
Energía del electrón en el nivel