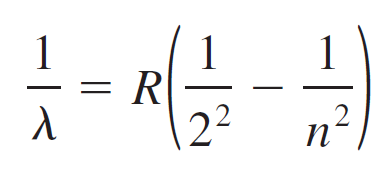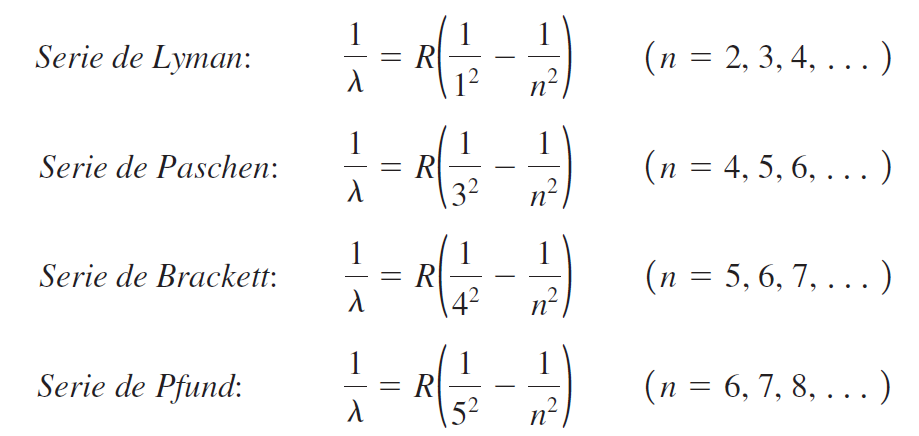3. Series espectrales
Las series espectrales representan las líneas de luz emitidas o absorbidas por el átomo de hidrógeno cuando su electrón salta entre niveles de energía cuantizados.
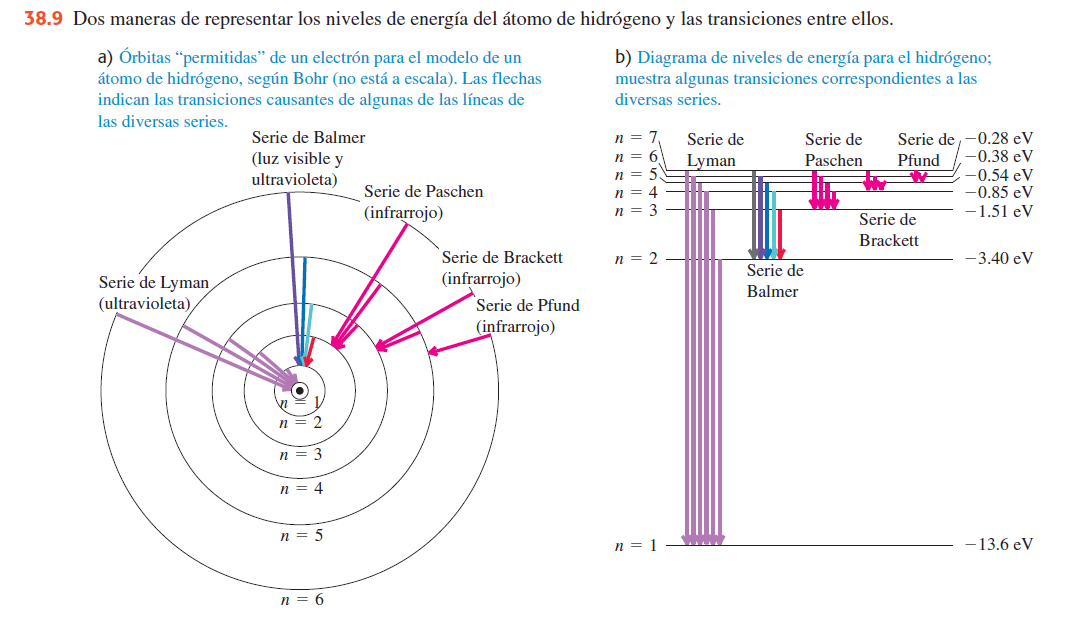
Cada serie (Lyman, Balmer, Paschen, Brackett y Pfund) corresponde a un nivel final fijo y ocupa una región diferente del espectro electromagnético, desde el ultravioleta hasta el infrarrojo.
Cuando un electrón en el átomo de hidrógeno salta de un nivel de energía alto a otro más bajo, el átomo emite un fotón cuya energía corresponde a la diferencia entre esos dos niveles:
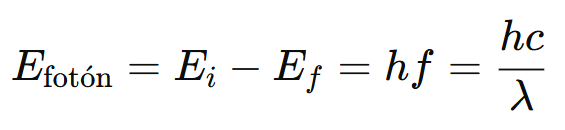
Ecuación general (fórmula de Rydberg)
La relación entre las longitudes de onda y los niveles cuánticos inicial y final está dada por la fórmula de Rydberg:
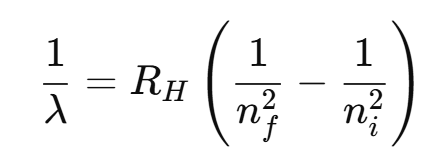
Como los niveles de energía son cuantizados, las diferencias de energía también lo son, por lo que el hidrógeno no emite un espectro continuo, sino líneas discretas (colores bien definidos).
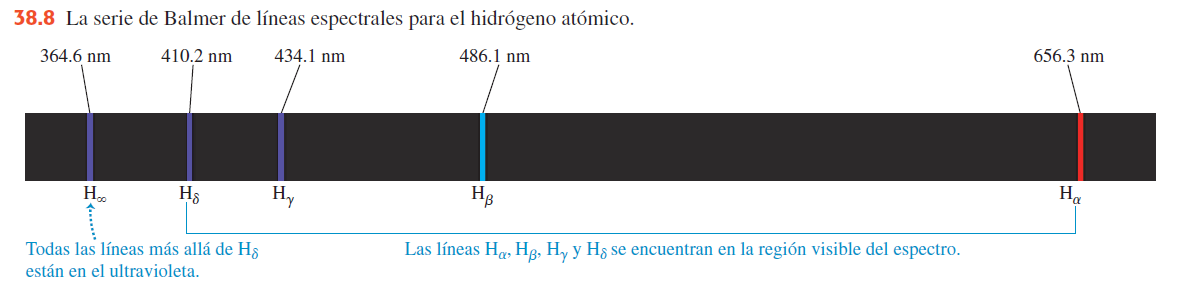
El espectro del hidrógeno
Para 1913 se había estudiado el espectro del hidrógeno, el átomo más simple y menos masivo, en forma extensa. En un tubo de descarga eléctrica, el hidrógeno atómico emite la serie de líneas que muestra la siguiente figura. La línea visible con la máxima longitud de onda, o frecuencia mínima, está en el rojo, y se llama Ha; la siguiente línea, en el azul-verde, se llama Hb, y así sucesivamente. En 1885 el profesor suizo Johann Balmer (1825-1898) encontró (mediante ensayo y error) una fórmula para calcular las longitudes de onda de tales líneas, que ahora se conoce como la serie de Balmer. La fórmula de Balmer se puede escribir como sigue: